Düzenleyici İşler
Martina Feichter, Innsbruck'ta eczacılık seçmeli dersi ile biyoloji okudu ve aynı zamanda şifalı bitkiler dünyasına daldı. Oradan, onu bu güne kadar büyüleyen diğer tıbbi konulara çok uzak değildi. Hamburg'daki Axel Springer Akademisi'nde gazetecilik eğitimi aldı ve 2007'den beri'da - önce editör, 2012'den beri de serbest yazar olarak çalışıyor.
houseofgoldhealthproducts uzmanları hakkında daha fazla bilgi Tüm içeriği tıp gazetecileri tarafından kontrol edilir.
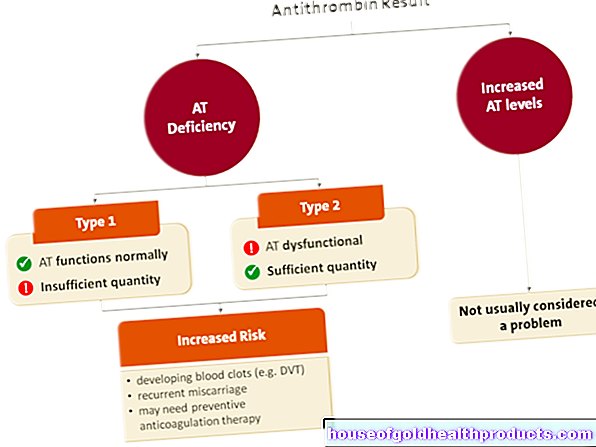
Belirli hastalıklara veya rahatsızlıklara karşı yeni aktif maddeler arayışı sıkıcıdır ve her zaman başarıyla sonuçlanmaz. İlaç firmalarının araştırma laboratuvarlarında test edilen 5.000 ila 10.000 umutludan ortalama olarak sadece biri eczanede bitmiş ilaç olarak bitiyor. Ve arada ortalama 13,5 yıl var.

"Hedefi" arayın
Araştırmacılar, yeni maddelerle testler yapılmadan önce bile, söz konusu maddenin özelliklerini ve vücutta hangi reaksiyonu tetiklemesi gerektiğini düşünürler. Bu, örneğin kan basıncını düşürmek, belirli bir haberci maddeyi bloke etmek veya bir hormon salgılamak olabilir.
Bu amaçla, araştırmacılar uygun bir "hedef", yani hastalık sürecinde aktif bir bileşenin eklenebileceği ve böylece hastalık sürecini olumlu yönde etkileyebileceği bir saldırı noktası arıyorlar. Çoğu durumda hedef, bir enzim veya bir reseptördür (hormonlar veya diğer haberci maddeler için hücreler üzerindeki kenetlenme noktası). Bazen hasta da belirli bir maddeden yoksundur. Daha sonra aradığınız ilacın bu eksikliği gidermesi gerektiği hemen anlaşılır. İyi bilinen bir örnek, diyabetli kişilerde insülindir (diabetes mellitus).
Aktif maddeyi arayın
Bir hedef belirlenir belirlenmez, bilim adamları seçilen saldırı noktasında (tarama) hareket edebilecek aktif bir bileşen ararlar. Bu genellikle şu anlama gelir: test, test, test. Her gün 300.000'e kadar farklı madde uygunlukları açısından incelenir (yüksek verimli tarama = HTS). Bunlardan yaklaşık her 200 ila 1000'inci madde, bazen çok küçük de olsa, seçilen hedef üzerinde aslında bir etki gösterir. Böyle bir vuruşa "hit" denir.
Test maddeleri çoğunlukla kimyasal olarak - yani sentetik olarak - üretilir. Bir süredir, genetiğiyle oynanmış maddeler de önem kazanıyor. Genetiği değiştirilmiş hücreler (bazı bakteriler gibi) yardımıyla elde edilirler ve biyofarmasötiklerin (biyolojik ilaçlar) temelini oluştururlar.
optimizasyon
Çoğu durumda, bulunan "isabetlerin" optimize edilmesi gerekir. Bazen, örneğin, yapısı biraz değiştirilirse, bir maddenin etkinliği arttırılabilir. Bu deneylerde, bilim adamları genellikle kimyasal bir değişimin madde üzerindeki etkisinin önceden tahmin edilebildiği bilgisayar simülasyonları ile çalışırlar. Prognoz iyiyse madde gerçek hayatta yani laboratuvarda ayarlanır. Hedef üzerindeki etkileri daha sonra tekrar incelenir.
Bu şekilde, araştırmacılar genellikle birkaç yıl süren yeni bir aktif maddeyi kademeli olarak geliştirirler.En iyi senaryoda, sonunda maddenin bir sonraki adım için hazır olduğu noktaya ulaşacaklar: bir patent başvurusu yapılır ve ardından aktif bileşen adayı olarak adlandırılan bir preklinik çalışmalara tabi tutulur.
Preklinik Çalışmalar
Klinik öncesi (klinik öncesi) geliştirme aşamasında, ilaç adayı test tüplerinde (örneğin hücre kültürleri üzerinde) ve hayvanlar üzerinde test edilir. Bir yandan, bu, örneğin hücrelerdeki veya tüm organizmadaki maddeye ne olduğu gibi farmakolojik sorunları içerir:
- Nasıl karşılanır?
- Vücutta nasıl dağılır?
- Hangi reaksiyonları tetikler?
- Değiştirilecek mi, sökülecek mi?
- O ortadan kaldırılacak mı?
Öte yandan bilim adamları, maddenin hedef üzerinde tam olarak ne gibi bir etkisi olduğunu, ne kadar sürdüğünü ve bunun için hangi dozun gerekli olduğunu araştırıyorlar.
Bununla birlikte, her şeyden önce, klinik öncesi çalışmalar, ilaç adayının toksisitesi (toksisitesi) hakkındaki soruları yanıtlamaya hizmet eder. Madde zehirli midir? Kansere neden olabilir mi? Genleri değiştirebilir mi? Bir embriyoya veya fetüse zarar verebilir mi?
Birçok ilaç adayı toksisite testlerinde başarısız olur. Yalnızca tüm güvenlik testlerini geçen maddelerin insanlar üzerinde yapılan çalışmalarla (klinik çalışmalar) bir sonraki geliştirme aşamasına girmesine izin verilir.
Mümkün olduğunda, örneğin hücre kültürleri, hücre parçaları veya izole edilmiş insan organları gibi test tüplerinde klinik öncesi testler yapılır. Ancak bazı sorular ancak canlı bir organizma üzerinde yapılan testlerde cevaplanabilir ve bunun için hayvan deneyleri gereklidir.
Klinik çalışmalar
İlaç adayı, klinik çalışmalarda ilk kez insanlar üzerinde test ediliyor. Birbiri üzerine inşa edilen üç çalışma aşaması arasında bir ayrım yapılır:
- Aşama I: İlaç adayı birkaç sağlıklı gönüllü (test denekleri) üzerinde test edilir.
- Aşama II: Bunu birkaç hasta insan üzerinde yapılan testler takip eder (örneğin, ilaç adayı yeni bir antihipertansif ajan olacaksa yüksek tansiyon hastalarında).
- Aşama III: Şimdi test çok sayıda hasta insan üzerinde gerçekleştiriliyor.
Her çalışma aşaması, sorumlu kuruluşlar tarafından önceden onaylanmalıdır: Bir yandan, bu, ilaç adayına bağlı olarak, Federal İlaç ve Tıbbi Cihazlar Enstitüsü (BfArM) veya Paul Ehrlich Enstitüsü (PEI) olmak üzere sorumlu ulusal makamı içerir. ). Öte yandan, her klinik çalışma (doktorlar, avukatlar, ilahiyatçılar ve sıradan insanlardan oluşan) bir etik kurulun iznine ihtiyaç duyar. Bu prosedür, çalışma katılımcılarını mümkün olan en iyi şekilde korumayı amaçlamaktadır.
İlaç adayını geliştiren ilaç üreticisi klinik çalışmaları kendisi yürütebilir. Veya bunu yapmak için bir "Klinik Araştırma Organizasyonu" (CRO) tutar. Bu, klinik çalışmalar yürütme konusunda uzmanlaşmış bir şirkettir.
Faz I çalışmaları
Genellikle bu eylem için gönüllü olan 60 ila 80 sağlıklı yetişkin, aşama I'de test kişisi olarak görev yapar. Kapsamlı bir açıklamadan ve çalışma katılımcılarının rızasından sonra, başlangıçta onlara sadece az miktarda aktif bileşen verilir.
30'a kadar ardışık testte, bilim adamları test tüpündeki ve hayvanlardaki testlerden elde edilen bulguların insanlara da aktarılıp aktarılamayacağını - yani aktif bileşenin klinik öncesi dönemde olduğu gibi emilip, dağıtılmadığı, dönüştürülüp dönüştürülmediğini kontrol eder. Testler belirlendi. Ayrıca test yaptıran kişilerin ilaç adayını ne kadar iyi tolere ettiği araştırılır.
Tablet, şırınga veya merhem?
Aşama I başarıyla tamamlandıktan sonra, sözde galenikler devreye giriyor: Bilim adamları şimdi aktif bileşen için en uygun "paketleme" üzerinde çalışıyorlar - damara tablet, kapsül, fitil, şırınga veya infüzyon olarak mı verilmeli?
Bu sorunun cevabı çok önemlidir: dozaj şekli, aktif bileşenin vücuttaki görevini ne kadar güvenilir, ne kadar hızlı ve ne kadar süreyle yerine getirebileceği üzerinde büyük bir etkiye sahiptir. Ayrıca olası yan etkilerin türünü ve şiddetini de etkiler. Bazı aktif bileşenler, gastrointestinal sistem yoluyla vücuda tablet şeklinde girdiklerine göre enjeksiyon olarak çok daha iyi tolere edilir.
Ayrıca galenik uzmanlar, yeni müstahzara hangi yardımcı maddelerin eklenip eklenmeyeceğini kontrol eder. Örneğin, ilacın tadını iyileştiren veya taşıyıcı veya koruyucu görevi gören bir şey.
Yeni bir aktif bileşen ve uygun yardımcı malzemeler için doğru "ambalaj" arayışı hakkında daha fazla bilgiyi Galenikler - Farmasötiklerin imalatı makalesinde okuyabilirsiniz.
Faz II ve Faz III çalışmaları
Aşama I'deki sağlıklı deneklerden sonra, ilaç adayını test etme sırası, evre II'deki hastaların sırasıdır:
- Faz II: Burada yeni ilaç adayı çoğunlukla 100 ila 500 hasta üzerinde test edilir. Odak, preparatın etkinliği, optimal dozu ve toleransıdır.
- Faz III: Faz II'dekiyle aynı kontroller burada, sadece önemli ölçüde daha fazla hastada (birkaç bin) gerçekleştirilir. Ayrıca diğer ilaçlarla olası etkileşimlere de dikkat edilir.
Her iki aşamada da farklı tedaviler birbiriyle karşılaştırılır: Hastaların sadece bir kısmı yeni ilacı alır, geri kalanı ya olağan veya tanıdık bir standart ilaç ya da plasebo alır - tıpatıp yenisine benzeyen ancak herhangi bir ilaç içermeyen bir müstahzar. aktif madde (sahte ilaç) . Kural olarak, ne hasta ne de tedavi eden doktor kimin ne aldığını bilmez. Bu tür "çift kör çalışmalar", doktorların ve hastaların umutlarının, korkularının veya şüpheci tutumlarının tedavinin sonucunu etkilemesini önlemek için tasarlanmıştır.
Onay verilmesi
Yeni bir ilaç gerekli tüm araştırmaları ve testleri geçmiş olsa bile, öylece satılamaz. Bunun için ilaç firmasının öncelikle yetkili merciden ilaç onayı başvurusu yapması gerekir (aşağıya bakınız: Onay seçenekleri). Bu, tüm çalışma sonuçlarını dikkatlice kontrol eder ve en iyi senaryoda, üreticiye yeni ilacı piyasaya sürme izni verir.
Faz IV
Bir ilaç onaylandıktan sonra bile, yetkililer ve ilaç şirketi, örneğin nadir görülen yan etkiler açısından, yeni müstahzarı izliyor. Bunlar, tedavi edilen 10.000 hastada 1'den azında meydana gelen istenmeyen etkilerdir ve bu nedenle önceki çalışma aşamalarında (daha küçük hasta gruplarıyla) güçlükle saptanabilir. Doktorların bir ilacın öngörülemeyen yan etkilerini bildirmeleri gerekmektedir.
Gerekirse, onay kuruluşu üreticiden bu yeni keşfedilen yan etkileri prospektüste belirtmesini isteyecektir. Bununla birlikte, kullanımla ilgili kısıtlamalar da getirebilir: Örneğin, böbrek bölgesinde nadir fakat ciddi yan etkiler keşfedilirse, yetkililer ilacın mevcut böbrek hastalığı olan kişilerde artık kullanılmamasını emredebilir.
Aşırı durumlarda, zaman içinde kullanımından kaynaklanan kabul edilemez riskler ortaya çıkarsa, yetkililer bir ilacın onayını tamamen geri çekebilir. Bazen üretici daha sonra gönüllü olarak böyle bir ürünü piyasadan çeker.
Doktorlar ayrıca, günlük yaşamda yeni ilacın hastaları için nasıl çalıştığını kaydetmek için günlükleri kullanır. Üretici, örneğin, preparasyonun dozajını veya dozaj formunu geliştirmek için bu tür gözlemsel çalışmaların sonuçlarını kullanır.
Bazen günlük uygulama, aktif bileşenin diğer hastalıklara karşı yardımcı olduğunu da gösterir. Üretici daha sonra genellikle bu yönde araştırmalara devam eder - yeni faz II ve III çalışmaları ile. Başarılı olursa, bu yeni endikasyon için onay için de başvurabilir.
Onay seçenekleri
Prensip olarak, bir ilaç firması yeni bir ilaç için onay için ya tüm AB için ya da sadece tek bir üye ülke için başvurabilir:
Merkezi onay süreci
İlaç onayı burada doğrudan Avrupa İlaç Ajansı'ndan (EMA) istenir. AB üye devletlerinin onay makamları da müteakip teste katılır. Başvuru onaylanırsa, müstahzar AB'nin herhangi bir yerinde satılabilir. Bu onay süreci ortalama bir buçuk yıl sürer ve bazı ilaçlar için zorunludur (örneğin biyoteknolojik olarak üretilmiş müstahzarlar ve yeni aktif içerikli kanser ilaçları için).
Ulusal onay süreci
Onay başvurusu ulusal makamlara ve dolayısıyla yalnızca ilgili ülkede sunulur. Almanya'da Federal İlaç ve Tıbbi Cihaz Enstitüsü (BfArM) ve Paul Ehrlich Enstitüsü (PEI) bundan sorumludur. BfArM insan ilaçlarının çoğuyla ilgilenir, PEI ise serumlar, aşılar, test alerjenleri, test serumları ve test antijenleri, kan ve kan ürünleri, gen tedavisi ve hücre tedavisi için dokular ve ilaçlarla ilgilenir.
Birkaç AB ülkesinde ilaç onayı
Ayrıca, bir ilaç firması birkaç AB ülkesinde onay almak isterse iki seçenek daha vardır:
- Merkezi olmayan prosedür: Bir "Merkezi Olmayan Prosedür"de (DCP), bir ilaç şirketi aynı anda Avrupa Ekonomik Alanının birkaç ülkesinde yeni bir ilaç için ulusal onay için başvurabilir.
- Karşılıklı Tanıma Prosedürü: Bir uyuşturucunun halihazırda Avrupa Ekonomik Alanı'ndaki bir ülkede ulusal onayı varsa, bu, "Karşılıklı Tanıma Prosedürü" (MRP) çerçevesinde diğer üye ülkeler tarafından tanınabilir.
Yeni bir ilaç için onay başvurusu ilaç firmaları için çok pahalıdır. Örneğin, EMA'da tamamen yeni bir aktif bileşen için onay başvurusu işlemek, en basit durumda yaklaşık 260.000 Euro'ya mal oluyor.
Standart onay
Bazı ilaçlar standart bir onayla satışa sunulur: Bunlar yeni geliştirilen müstahzarlar değil, yasa koyucu tarafından şart koşulan belirli monograflara dayanan imalatlardır. Ayrıca bu tıbbi ürünler insanlar veya hayvanlar için herhangi bir tehlike oluşturmamalıdır. Bir monografta (örneğin, 250 mg parasetamol fitiller için), diğer şeylerin yanı sıra, söz konusu müstahzarın bileşimi ve dozu, uygulama alanı gibi kesin olarak tanımlanır.
Tüm bu gerekliliklere uyulursa, üreticinin kendi bireysel ilaç onayı için başvurması gerekmez. Bu, ilaçları piyasaya çok uygun bir fiyata getirmesini sağlar. Çeşitli dozlarda kömür tabletleri (250 mg), atropin göz damlaları ve çeşitli konsantrasyonlardaki solüsyonların yanı sıra parasetamol fitiller ve asetilsalisilik asit tabletleri için standart onaylar mevcuttur.
Örneğin eczacıların, ilgili farmakopedeki talimatlara göre bir salin solüsyonu hazırlamasına ve ardından satmasına da izin verilir. Ancak, onay makamına ve sorumlu devlet makamına böyle bir standart onayın kullanıldığını belirtmelisiniz.
İlaç onayı almanın diğer yolları
AB'de, geleneksel onay prosedürüne ek olarak, yeni bir ilacı normalden daha erken kullanıma sunma seçenekleri de vardır. Bunlar sadece hızlı onaylar değildir. Bunun yerine, etkilenenlerin geleneksel ilaç onayı olmadan bile aktif bileşenlerden yararlanabilmelerini sağlamak için çeşitli şekillerde girişimlerde bulunulmaktadır. Uzmanlar, sözde uyarlanabilir yollardan bahseder:
Şefkatli kullanım programları
Burada, çok spesifik hastalar, aslında halen klinik deneylerde olan ilaçları alırlar. Ön koşul, artık başka bir tedavi seçeneğinin olmaması ve hastanın bu ilaçla ilgili ilgili bir çalışmaya katılamamasıdır. Bu muafiyetler her bir hasta için ayrı ayrı uygulanmalıdır.
Tıbbi ürünler için şartlı onay
Bu, tabiri caizse, hızlı bir onaydır. Sıkı etkinlik ve güvenlik testlerinin, aksi takdirde olağan olan ölçüde mevcut olması gerekmez. Ancak, belirli koşullar geçerlidir:
- Şartlı ilaç onayı zamanla sınırlıdır.
- Üretici, düzenli ilaç onayı için gerekli olan eksik belgeleri sağlamalıdır.
Koşullu onay, örneğin pandemilerde bulaşıcı hastalığa karşı uygun bir ilacı hızlı bir şekilde sağlamak için kullanılır.
İstisnai durumlarda onay
Bu özel rota, örneğin nadir hastalıklar için mevcuttur. Hasta sayısı çok az olduğu için, ilaç firmasının aksi halde gerekli miktarda veriyi incelemeye göndermesi mümkün değildir. Bununla birlikte, bu ilaç onayı ile üretici genellikle yeni veri ve bulgular olup olmadığını yıllık olarak kontrol etmek zorundadır.
Hızlandırılmış ilaç onayı (hızlandırılmış değerlendirme)
Onay belgeleri, 150 günde olağan 210 yerine, sorumlu EMA komitesi tarafından daha hızlı kontrol edilir ve değerlendirilir. Bu yol, şu ana kadar tam olarak tedavi edilemeyen bir hastalığa karşı umut verici bir etken madde varsa mümkündür.
Öncelikli ilaçlar (PRIME)
Bir ihtiyacın hala karşılanmadığı bu gibi durumlarda, EMA ve ilaç üreticisi çok erken aşamada - ilk testler sırasında bile - birlikte çalışabilir. Bu şekilde uzmanlar, etkililiği ve güvenliği erken bir aşamada değerlendirebilir ve ilacın umut verici olduğu kanıtlanırsa daha fazla prosedürleri daha hızlı başlatabilir.
Sürekli gözden geçirme (sürekli gözden geçirme)
Acil olarak ihtiyaç duyulan ilaçlar ve aşılar durumunda, EMA - daha önce belirtildiği gibi - aktif bileşenleri "şartlı olarak" onaylayabilir veya nihai onaydan önce üreticilerle erken bir aşamada çalışabilir. Önemli durumlarda, sözde haddeleme inceleme süreci bu onaylardan önce başlar. Uzmanlar, üretici aksi takdirde ilgili tüm belgeleri onay için göndermeden önce mevcut verileri değerlendirir. Ayrıca, daha sonraki çalışmalardan elde edilen tüm yeni sonuçları sürekli olarak kontrol ederler.
Örneğin, EMA, koronavirüs pandemisi sırasında viral ilaç remdesivir'in koşullu onayına yuvarlanan inceleme sürecini uyguladı. Korona aşıları için onay sürecinin bir parçası olarak uzmanlar, halihazırda mevcut olan ve daha sonra devam eden faz III çalışmaları sırasında elde edilen sonuçları da kontrol etti.
Çocuklar için ilaçlar
Yeni ilaçlar, piyasaya çıkmalarına izin verilmeden önce genellikle birkaç çalışmadan geçer. Bununla birlikte, uzun bir süre, bir grup hasta araştırmalarda daha az ilgi gördü: çocuklar ve ergenler. Küçüklerin tedavisi için, yetişkinlerde test edilen bir ilacın dozu genellikle basitçe azaltıldı.
Ancak, 2007'den bu yana, AB'deki her yeni uyuşturucu, bu yaş grubunda daha sonra kullanılacaksa, faz II ve III çalışmalarında reşit olmayanlar üzerinde test edilmek zorunda kalmıştır. Çocuklar veya ergenler üzerindeki testler genellikle ancak yetişkinler üzerindeki II. Aşama çalışmaları başarıyla tamamlandıktan sonra başlatılır. Avrupa İlaç Ajansı EMA'dan ayrı bir uzman grubu olan Pediatri Komitesi ayrıntılara karar verir.
Çocukların ve ergenlerin bedenleri genellikle bir ilaca yetişkinlerinkinden farklı tepki verdiğinden, reşit olmayanlar üzerindeki kabul testleri anlamlıdır. Bu nedenle etkinlik ve tolere edilebilirlik farklı olabilir. Dozaj bu nedenle genellikle küçükler için ayarlanmalıdır. Çoğu durumda, çocuklara yönelik ilaçlar için farklı bir uygulama şekli gereklidir - örneğin yetişkin hastaların aldığı büyük tabletler yerine damla veya toz gibi.
Bitkisel ilaçlar
Yeni bitkisel tıbbi ürünler (fitoterapötik ajanlar) geliştirilirken, klinik çalışmalar şeklinde öngörüldüğü şekilde etkililik kanıtı zordur:
Kimyasal ilaçlar genellikle bir veya ikiden fazla saf madde içermezken, her bitki bir etken madde karışımı üretir. Çoğu zaman bu karışım bitkinin farklı yerlerinde de değişiklik gösterir. Örneğin ısırgan otu böbrekleri etkileyebilirken ısırgan kökü prostatın hormon metabolizmasını etkileyebilir. Ayrıca bu etken madde karışımları bitkinin kökenine ve hazırlanışına bağlı olarak büyük ölçüde farklılık gösterir ve bu da etkinliği etkiler.
1978'de bu tür soruları açıklığa kavuşturmak için E Komisyonu adı verilen bir uzman grubu kuruldu. Bunlar, çeşitli şifalı bitkilerin bileşimi, etkileri ve olası yan etkileri hakkında o sırada bilinen bilgileri içerir.
E Komisyonu monografları 1994 yılından beri güncellenmediği için bunun yerine “Bitkisel Tıbbi Ürünler Komitesi” (HMPC) monografları kullanılmaktadır. Bu, Avrupa İlaç Ajansı'nın bitkisel ilaçlardan sorumlu komitesidir. Bu tür ilaçların bilimsel değerlendirilmesiyle ilgilenir.
Geleneksel bitkisel tıbbi ürünler ile modern bitkisel tıbbi ürünler arasında bir ayrım yapılmalıdır: onay yerine kayıt gereklidir. Bir sonraki bölümde bu konuda daha fazlası.
Kabul yerine kayıt
Geleneksel bitkisel tıbbi ürünler ve homeopatik müstahzarlar, "özel tedaviler" tıbbi ürünleri olarak lisans gerekliliğinden muaftır. Bunun yerine, kayıt olmanız gerekir:
Bunun için - "normal" tıbbi ürünlerin onayında olduğu gibi - homeopatik veya geleneksel bitkisel tıbbi ürünün zararsızlığının ve uygun farmasötik kalitesinin kanıtı sunulmalıdır.
Geleneksel bitkisel tıbbi ürünler söz konusu olduğunda, farmakolojik etki veya etkililik de - geleneksel kanıt olarak bilinenler kullanılarak - makul bir şekilde gösterilmelidir. Bu, üreticinin diğer şeylerin yanı sıra geleneksel bitkisel tıbbi ürünün AB'de tıbbi olarak en az 15 yıl dahil en az 30 yıldır kullanıldığını kanıtlamak için bibliyografik bilgileri kullanması gerektiği anlamına gelir.
Bununla birlikte, klasik ilaç onayında belirtildiği gibi etkinliğini kanıtlamak için yapılan klinik çalışmalar, bir şirketin bunları satabilmesi için ne homeopatik ne de geleneksel bitkisel ilaçlar için gerekli değildir.
Geleneksel tıptaki geleneksel ilaçların aksine, alternatif ilaçlar, özellikle zaman alıcı ilaç onay süreci gerekmediğinden, etkinliklerinin kapsamlı bilimsel kanıtlarından genellikle yoksundur.
Etiketler: menopoz Teşhis seyahat ilacı